여러분들은 MUSE를 아는가?영국의 밴드 MUSE는 옜날 Oasis와 함께 필자가 정말 좋아했던 밴드다. MUSE의 정규 6집 이름은 다음과 같다.
The 2nd Law
바로 열역학 제 2법칙을 의미한다. 왜 이런 이름을 붙였을까? 사실 잘 모르겠다. 11, 12, 13 트랙이름도 뭔가 열역학과 관계가 있을것만 같다. 매튜는 왜 이렇게 만들었을까?
열역학이라는 것은 사실 안다고해서 뭔가 내가 대단한것을 할 수 있지는 않다. 다만, 이를 이해하고나면 세상을 바라보는 시각이 완전히 대격변한다. 이해하기 전과는 완전히 다른 시각으로 이 세상을 바라볼 수 있게 된다. 가끔 자칭 '교수' 또는 '박사'들이 발명했다고 하는 무한동력 또는 영구기관이 얼마나 실현 불가능한 것인지 부터 시작해서 말이다.
이 글에서는 3가지 기본적인 열역학 법칙을 소개한다. 다음 열역학 법칙들은 '공리' 로써 받아들여지고 있다. 특히 2법칙은 말이다.
1. 열역학 제 1법칙, Thermodynamics 1st Law
The total energy of the universe is constant.
어떤 시스템의 에너지의 총 합은 일정하다 라는 뜻이다. 에너지 보존 법칙 이라는 말들 들어보았는가? 어떤 closed system에 존재하는 에너지는 그 형태가 바뀔 수는 있지만 새로이 생성되거나 사라지지 않는다. 예를 들어 생각해보자.
필자가 너무 잠이 오는 나머지 잠을 깨기위해 책상을 내리쳤다. 그러면 이 책상을 내리치는데 사용된 이 에너지는 어떻게 될까? 책상에 부딪치며 충격 에너지와, 쾅 하는 소리로 변환 될 것이다.
나무에 불을 붙이면 어떻게 될까? 나무는 새카맣게 타면서 열에너지를 발산하고, 바스라질것이다.
즉 에너지 보존이란 이런 개념이다. 닫힌 계에서 내부 에너지는 다음과 같이 표현된다.
$ U = q + w $
$ \mathrm{d} U = \delta q + \delta w $
열역학에서는 이 일과 에너지를 압력과 부피 그리고 온도로 설명하고 있다. $ \delta w $는 어떤 시스템이 외부로 행한 일을 의미한다. 그리고 $ \delta q $는 흡열이든 발열이든 발생한 열의 이동을 의미한다. 즉 우리가 관심을 가지고 있는 어떤 시스템의 내부 에너지는 열의 이동과 일의 양으로 표현할 수 있다 는 의미다.
2. 열역학 제 2법칙, Thermodynamics 2nd Law
Energy spontaneously tends to flow only from being concentrated in one place to becoming diffused or dispersed and spread out.(Entropy Increases).
에너지는 한곳에 집중되어있지 않고 '자발적'으로 확산되거나 흩어져 퍼져있으려한다(엔트로피는 증가한다). 라는 의미다. 다른 글에서 작성했던 다음 예를 한번 생각해보자.
필자가 방구를 뀌었다고 가정해보자. 이 방구는 어떻게 되겠는가? 우리는 경험적으로 알고있다. 이 방구는 곧 공기와 섞여 무질서하게 확산된 후 주변 사람들의 코로 퍼져나가 냄새를 맡게된다. 그리곤 점차 농도가 낮아지면서 냄새는 사라진다. 그럼 이 방구는 왜 방구 가스끼리 뭉쳐있지 않고 확산하는 걸까? 왜 확산된 방구 가스는 다시 뭉치지 않는 것일까? 이 현상에 대한 답은 없다. 이것이 바로 에너지가 감소하며 동시에 엔트로피가 증가하는 방향으로의 변화이기 때문이다.
한여름 냉장고에서 시원한 물을 한병 꺼냈다. 한입 마신 후 상온에 약 6시간 정도 두었다. 그럼 이 물은 어떻게 될까? 이또한 우리는 경험적으로 너무나도 잘알고있다. 물은 주변의 온도를 따라 아주 뜨뜨미지근한 온도가 될것이다. 왜 이 물은 다시 시원해지지 않을까? 이러한 현상 또한 답은 없다. 우리 자연이 그러한 것이다.
도대체 이 세계가 왜 이런 거동을 보이는지, 왜 그렇게 디자인 되었는지 우리는 알수 없지만 경험적으로 알고 있다. 이러한 사실을 우리는 '공리'라 부르며 자연히 그러한 것으로 받아들인다.
2-1. 고전적 Entropy
고전적인 의미의 엔트로피는 변화량으로써 정의 된다.
$ \begin{align} \Delta S = \frac{ \delta q }{ T } \end{align} $
$ \begin{align} \mathrm{d} S = \frac{ \delta q }{ T } \end{align} $
이를 열역학 1법칙과 결합하면
$ \begin{align} \mathrm{d} U & = \delta q + \delta w \\ &= TdS + \delta w \\ &= TdS - PdV \end{align} $
우리 계(system)의 에너지는 온도 & 엔트로피 & 압력 & 부피로 설명할 수 있다.
2-2. 통계적 Entropy
통계역학적 관점에서 이 엔트로피를 한번 바라보자. 이제 우리는 이 엔트로피를 closed system 내에서 입자들이 가질 수 있는 경우의 수 로 해석할 수 있다.
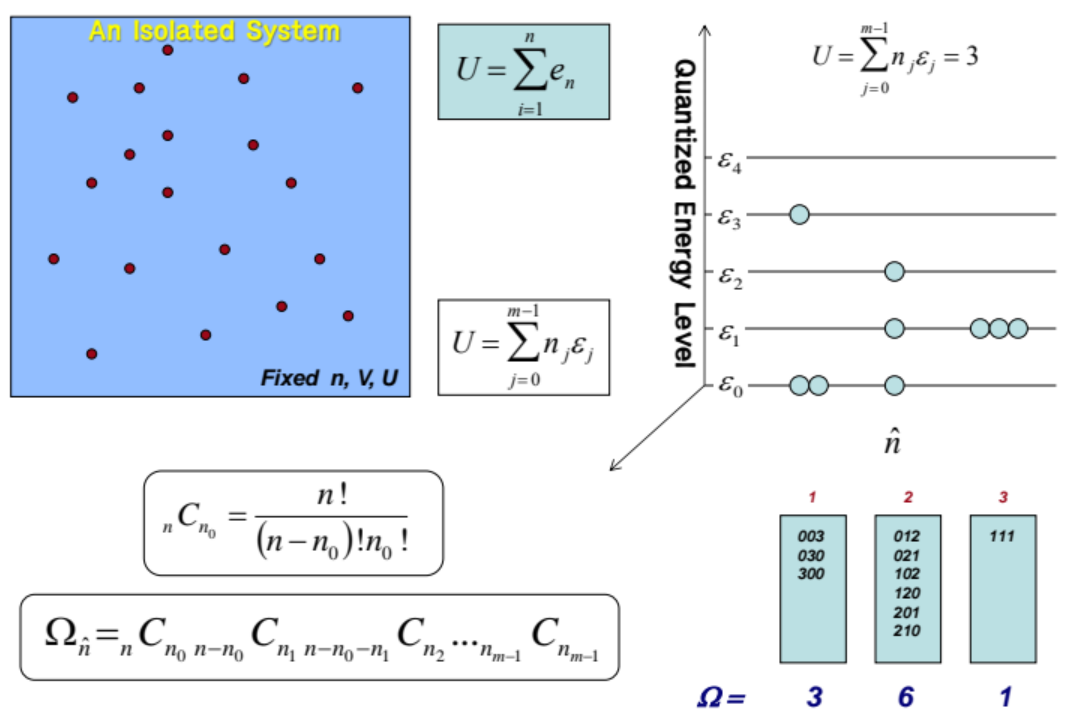
우리 계의 내부에너지(U)는 다음과 같이 각 개별 입자들의 에너지의 합으로 나타낼수 있다.
$ U = \sum_{i=1}^{n} e_n $
또한 이 개별 입자들의 에너지의 합은 입자의 수와 입자가 가질수 있는 에너지 준위의 경우의 수로 나타낼 수 있다. 입자가 가질수 있는 에너지 준위는 양자화되어있다.
$ U = \sum_{ j=0 }^{ m-1 } n_j \varepsilon_j $
위 그림처럼 3개의 입자가 각각 3개의 양자화된 에너지 준위를 가질 수 있는 상황을 고려해보자. 그럼 이 계산은 Combination이고 입자가 가질 수 있는 미시 상태의 수는 10개가 된다. (파울리의 배타원리는 여기서 고려하지 않는다) 다음 표를 보자.
| CASE | 경우의 수 | 확률 |
| 한 에너지 준위에 모든입자가 존재 | 3 | $ \frac{3}{10} $ |
| 에너지 준위 당 0-1-2 로 존재 | 6 | $ \frac{6}{10} $ |
| 모든 에너지 준위에 하나씩 존재 | 1 | $ \frac{1}{10} $ |
입자가 가질수있는 미시 상태의 모든 상태의 수를 우리는 $ \Omega $ 로 표현한다.
$ \Omega = {}_{3} \rm C _{1}\times {}_{3} \rm C _{2}\times {}_{3} \rm C _{3} = 10 $
통계적 관점에서 엔트로피(S)는 다음 식으로 정의된다. $ k_B $는 볼츠만 상수다.
$ S = k_B \ln \Omega $
$ k_B = 1.38 \times 10^{-23} J/K $
2-3. 평형 상태 Equilibrium State
이제 우리는 '평형 상태'라는 개념을 생각해야 한다. 어떤 시스템이 평형 상태에 있으면 거시적인 관점에서는 더이상 에너지나 물질의 이동이 없어진다. 즉 이는 이 시스템의 엔트로피가 최대화 되었다고 생각할 수 있다. 그리고 시스템은 항상 자발적으로 평형상태가 되려한다. 또한 통계학적 관점에서 이 시스템이 최대한 많은 경우의 수를 가지는 상태가 되면 이를 엔트로피가 최대화 되었다 라고 생각할 수 있다.
즉 평형 상태에서는 $ \Omega $가 최대가 되며 따라서 엔트로피 $ S = k_B \ln \Omega $ 도 최대가 된다. 이는 우리 시스템이 가능한 많은 상태를 가지려고 하기 때문이며 그것이 에너지가 가장 낮아지고, 또 엔트로피가 최대화 되는 상태이기 때문이다.

$ \hat{n} $ 은 배치가능한 분포의 모든 경우의 수를 의미한다. 즉 입자 3개와 에너지 준위 3개가 있는 어떤 시스템에서는 다음 표와 같다.
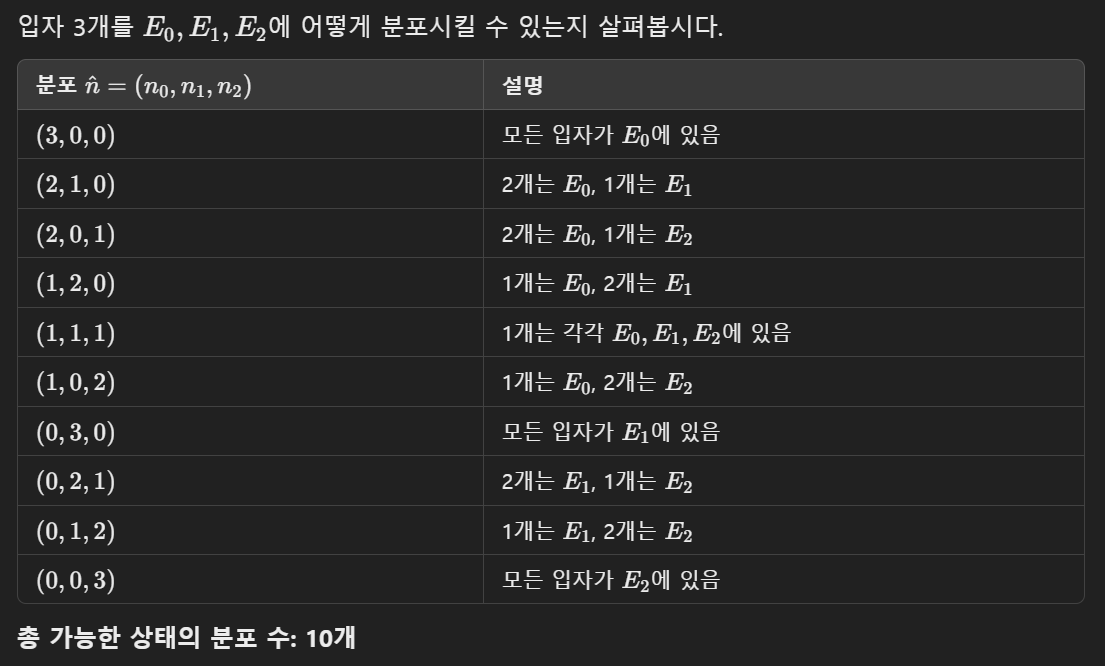
그럴 때 입자를 배치할 수 있는 경우의 수 $ \Omega $ 는 다음표와 같다.

따라서 각 에너지 준위에 입자들이 하나씩 배치된 (1,1,1) 상태가 가장 엔트로피가 높으며(세개의 빈 자리에 3개의 입자를 배치하는 경우의 수를 고려해보라) 우리 시스템이 '자발적'으로 움직이는 방향으로 볼 수 있다. 또 가장 무질서한 상태이며 필자가 생각하는 무질서한 질서가 바로 이런 의미이다. 우리 시스템은 이렇게 항상 질서정연하게 무질서하려 한다.
2법칙에서 엔트로피에 대한 내용은 여기까지만 다루도록 하겠다.
3. 열역학 제 3법칙, Thermodynamics 3rd Law
The entropy of a closed system at thermodynamic equilibrium approaches a constant value when its temperature approaches absolute zero. (Wikipedia)
절대 영도(0K)의 열적 평형상태에 있는 닫힌 계의 엔트로피는 상수다.
재료공학적 관점에서 얘기해보자면 완벽한 절대영도에서는 결정 격자(crystal lattice) 내에서 defect가 발생하지 않는다. 따라서 어떤 결정이든 완전 무결한 상태를 가지고 이때 엔트로피는 0 또는 상수다.
다시 말해 외부로부터 어떠한 에너지도 공급되지 않는 상황에서는 그 어떤 떨림, 진동, 결함등이 존재하지 않는 모든것이 멈춰있는 고요한 상태가 된다는 것이다. 반대로 말하자면 이는 우리 세계에서는 어떤 방법으로든 엔트로피가 증가하며, 또 완벽한 절대 영도에 무한히 근접할수는 있지만, 절대 달성할 수는 없음을 의미하기도 한다.
사실 우리 세상의 과학과 공학의 많은 부분이 그렇다. 우리 세상에 순도 100%라는게 있을까? 현재까지 있지도 않지만 앞으로 등장할수도 없을 것이다. 특별한 과정을거쳐 순도를 높인다해도 3k = 99.999%, 6k = 99.999999% 처럼 끝없이 순수에 가까워질 뿐, 절대 100%를 달성할 순 없다.
4. 무한 동력과 영구 기관
MZ 독자들은 한문 교육을 배웠을지 모르겠다. 필자는 중-고등학교 과정에서 한문 수업을 많이 들었다. 무한동력(無限動力)과 영구기관(永久機關) 둘다 한자어다. 둘은 어느정도 비슷한 의미를 가지고 있다. 무한동력은 '무한하게 운동하는 어떤 힘'이란 뜻이고 영구기관은 '길고 오래가는 기계장치' 라는 뜻을 가지고 있다. '영구' 라는 단어 자체는 굉장히 친숙할 것이다.
이 챕터에서는 이 외부에서 에너지를 주지 않아도 일을 할 수 있는 영구기관에 대해서 다뤄볼 것이다.
4-1. 1종 영구기관
1종 영구기관은 열역학 제 1법칙에 위배되는 힘을 가진 기계를 뜻한다. 열역학 제 1법칙은 다음과 같았다.
$ \begin{align} U &= q + w \\ dU &= \delta q + \delta w \end{align} $
열역학 제 1법칙을 다시 한번 설명 해 보자면 다음 세 가지로 축약해볼 수 있겠다.
- 어떤 닫힌 계(closed system) 에서의 내부 에너지는 보존된다.
- 내부에너지는 열(q)과 일(w)의 합으로 나타낼 수 있다.
- 에너지는 사라지거나 새롭게 생기지 않으며 어떤 에너지에서 다른 에너지로 변환될 뿐이다.
잘 이해가 안되는 독자들을 위해 다시한번 예를 들어 설명해보겠다. 현대 문명사회에서 '에너지'는 가장 중요한 기본적인 요소다. 인류 문명과 지식을 사용하고 유지&보존 하기 위해서는 이 에너지가 반드시 필요하며 특히나 우리는 이러한 에너지들을 '전기' 라는 형태로 사용한다. 자 그럼 이 '전기'는 어떻게 만들어질까?
현대 사회에서 전기를 '생산' 하는 방법은 크게 세가지가 있다.
- 화력 발전(석탄, 석유)
- 원자력 발전
- 기타 발전(태양열, 풍력 등)
이 세개 발전에 대해서 잘 생각해보자.
- 화력 발전은 석탄or석유를 태워 물을 끓인다. 그리고 이 수증기압을 이용해 '터빈'을 돌려 전기를 생산한다.
- 원자력 발전은 핵분열 반응에 의해 발생하는 열로 물을 끓인다. 그리고 '터빈'을 돌린다.
- 태양력은 태양열 에너지 자체를 이용하고, 풍력 발전은 바람으로 풍차를 돌려 전기를 생산한다.
- 수력 발전은 전기 에너지 $\leftrightarrow$ 포텐셜 에너지 서로 변환해주는 시설이다.
즉 태양열 제외한 나머는 $ \text{화력,원자력,풍력} \rightarrow \text{회전 운동} \rightarrow \text{전기} $ 과정을 가진다. 이제 여러분들은 다음 질문에 대해 답을 할 수 있을것이다. 과연 에너지가 새롭게 생성되거나 사라졌을까? 답은 No다. 모두 포텐셜에너지가 운동에너지로 전환되고 또 이 운동에너지를 이용해 전기를 생산했다.
즉 우리 지구 또는 크게 보았을 때 우주라는 시스템 안에서 새롭게 에너지를 생성하거나 소멸시킬 수 있는 방법은 존재하지 않으며 모두 다른 형태로 변환될 뿐이다.
4-2. 2종 영구기관
2종 영구기관은 열역학 제 2법칙에 위배되는 영구기관이다. 열역학 제 2법칙은 다음과 같았다.
에너지는 한곳에 집중되어있지 않고 '자발적'으로 확산되거나 흩어져 퍼져있으려한다(엔트로피는 증가한다). 여기서 핵심은 다음 세가지다.
- 자발적 반응
- 에너지는 흩어지려 한다(Energy Minimization)
- 엔트로피는 증가한다(Entropy Maximization)
우리 시스템과 주어진 환경에서 어떤 것이 자발적인 방향인가? 왜 겨울에 물은 차가워지며 여름에 뜨뜨미지근해질까? 왜 여름에 물이 다시 차가워지거나 자연적으로 얼음이 생기지 않을까? 이 모든것이 열역학 제 2법칙에 위배되기 때문이다.
위에서 애기했던 에너지의 변환 과정에서 과연 아무런 손실이 없을까? 내연기관은 실제 열 효율이 40~50% 대에서 논다. 외연기관으로 얘기해보자면 더더욱 효율이 떨어진다. 또 터빈을 돌리는데 드는 마찰력은? 전기를 송-배전하는데 있어 발생하는 발열과 손실은? 사실 이 모든것들을 고려했을때 우리 인류의 열 효율이라는 것은 정말 처참한 수준이다. 아무튼, 태양열 발전의 경우에도 우주의 관점에서 본다면 태양의 격렬한 핵융합 반응으로 발생한 열을 우리는 전기라는 형태로 변환할 뿐이다. 이 과정에서도 물론 손실이 존재한다.
즉 우리 지구 또는 크게 보았을 때 우주라는 시스템 안에서 새롭게 에너지를 생성하거나 소멸시킬 수 있는 방법은 존재하지 않으며 모두 다른 형태로 변환될 뿐이다. 또한 그 과정에서 크든 작든 어쨋거나 손실이 발생한다.
우리는 여름에 에어컨을 사용한다. 에어컨은 냉매가 공기를 냉각하는 원리다. 하지만, 공기를 순환시키고 따뜻해진 냉매를 다시 차갑게 만드는데 사용되는 에너지는? 그때 발생하는 손실(열)은? 결국 지구를 더 뜨겁게 만들것이다.
현실 세계에서 어떤 물체를 운동하게 한 힘은 100%가 오롯이 운동에너지로 전환되어 무한하게 일을 할수는 없다는 것이다. 또한 자발적이지 않은, 반대 반응은 절대로 일어날 수 없다(전기와 냉각 시스템이 없는 냉장고와 같은). 그리고 냉장고 또한 동작하면서 에어컨처럼 열이라는 손실이 발생하며 결국 엔트로피는 증가한다.
'기타' 카테고리의 다른 글
| 푸리에 변환(fourier transform) (0) | 2025.01.02 |
|---|---|
| 푸리에 급수(Fourier Series) (0) | 2024.12.27 |
| 열역학(Thermodynamics) 배경 지식 (0) | 2024.12.19 |
| [electronics] 교류&임피던스와 RLC 공진 (0) | 2024.12.17 |
| [electronics] 인덕터(lnductor)와 인덕턴스(lnductance) (0) | 2024.12.16 |